Bohrin atomimalli#
Tanskalainen fyysikon ja kemistin Nils Bohrin 1900-luvun alussa kehittämä atomimalli auttaa selittämään muunmuassa
miksi eri alkuaineet reagoivat eri tavalla
mikä erottaa metalliatomit epämetalliatomeista
alkuaineiden jaksollisen järjestelmän pääryhmien ominaisuuksia
atomien suhteellisia kokoja
elektronien sijoittumista eri elektronikuorille, tai tarkemmin sanottuna energiatasoille
alkuaineiden kyvyn absorboida ja emittoida vain tietyn kokoisia energioita, eli kvantittuneita photoneja, mikä voidaan havaita spektriviivoina
kuinka paljon energiaa tarvitaan ionisoimaan atomi, eli irrotamaan siitä yksi tai useampi elektroni atomista
Bohrin atomimallissa on kuitenkin myös rajoituksia. Malli toimii hyvin käytännössä vain 20 pienimmälle alkuaineelle, eikä se pysty selittämään tarkasti atomien monimutkaista käyttäytymistä. Toki täytyy muistaa, että myös monimutkaisemmissa atomimalleissa, kuten orbitaalimallissa, on omat rajoituksensa.
Bohrin atomimalli perustuu ajatukselle, että atomi koostuu ytimessä olevista protoneista ja neutroneista, joiden ympärillä liikkuu elektroneja eri energiatasoilla. Bohrin mallin mukaan elektronit liikkuvat ytimen ympärillä tietyillä, tarkkaan määritellyillä elektronikuorilla, joita merkintään kirjaimilla K, L, M, N jne. Nämä radat vastaavat eri energiatasoja, joilla elektroni voi olla.
Elektronit täyttävät elektronikuoret sisimmältä kuorelta alkaen siten, että jokaiselle kuorelle mahtuu enintään \( 2n^2 \) elektronia, jossa \( n \) on kuoren numero, kuitenkin niin, että uloimmalla elektronikuorella voi olla enintään 8 ulkoelektronia eli valenssielektronia.
Kuoren nro |
elektronien suurin mahdollinen määrä |
|---|---|
1 |
\(2 \cdot 1^2=2\) |
2 |
\(2 \cdot 2^2=8\) |
3 |
\(2 \cdot 3^2=18\) |
4 |
\(2 \cdot 4^2=32\) |
… |
|
n |
\(2 \cdot n^2\) |
Tarkastellaan esimerkiksi natriumia \( (Na) \).
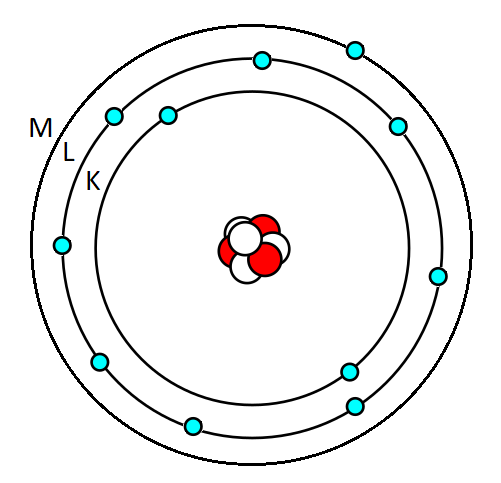
Fig. 9 Elektronien sijoittuminen natriumin elektronikuorille#
Natriumin järjestysluku on \( Z = 11 \) ja elektronit täyttyvät elektronikuorille seuraavasti:
K-kuorelle mahtuu 2 elektronia, minkä jälkeen kuori on täynnä.
L-kuorelle mahtuu 8 elektronia \((\)koska \(2 \cdot 2^2=8)\).
Täten viimeinen elektroni sijaitsee M-kuorelle Myös oktettisäännön mukaan L-kuorella ei voi olla yhdeksää elektronia, joten yhdennentoista elektronin on oltava kolmannella, eli M-kuorella.
Kun atomi saa energiaa, esimerkiksi lämpötilan tai valon vaikutuksesta, elektroni siirtyy korkeammalle energiatasolle. Kun elektroni palaa takaisin matalammalle energiatasolle, se vapauttaa energiaa sähkömagneettisena säteilynä. Jos energia vapautuu näkyvän valon aallonpituuden alueella, ilmiö näkyy spektrissä, jossa jokainen väri vastaa tiettyä energiatasoa. Esimerkiksi metalliesineen laittaminen mikroaaltouuniin aiheuttaa näkyvän reaktion, kun metalliatomien absorboima energia vapautuu kipinöiden kera.
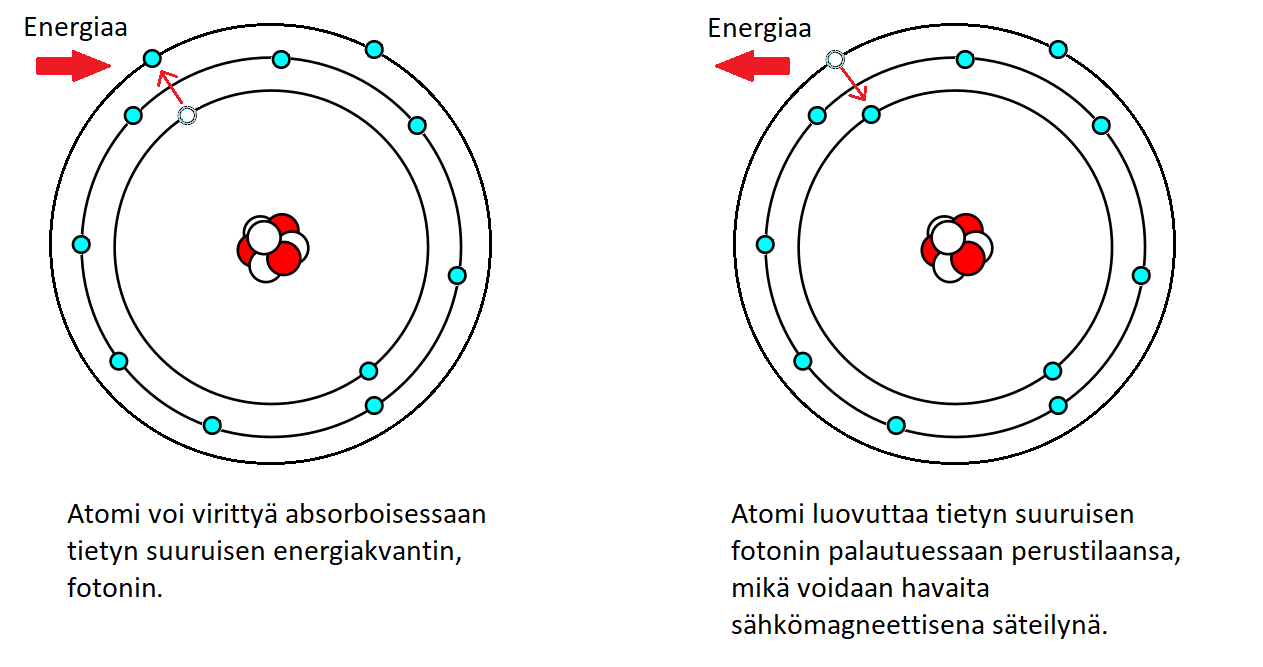
Fig. 10 Elektronin siirtyminen korkeammalle energiatasolle, M-kuorelle, ja palautuminen perustilaan#
