Peruskäsitteitä#
Atomien ominaisuuksia#
Alkuaine#
on yksinkertaisin mahdollinen kemiallinen aine. Alkuaineilla on yksilöllinen kemiallinen merkki ja niillä on tietty määrä protoneja ytimessään, joka määrittää alkuaineen atomityypin. Alkuaineita tunnetaan hieman yli 110. Esimerkiksi rauta on alkuaine, sen merkki on Fe ja se koostuu rauta-atomeista, joilla on 26 protonia ytimessään. Muita esimerkkejä alkuaineista ovat kalsium (Ca), kulta (Au) ja happi (O).
Atomi#
on alkuaineen perusyksikkö. Se koostuu ytimestä sekä elektroneista, jotka kiertävät ydintä elektronipilvessä. Atomien koko eri alkuaineilla vaihtelee.
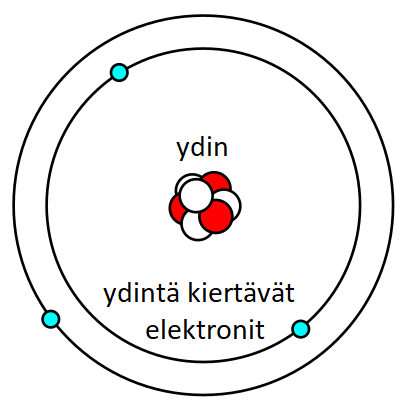
Fig. 1 Atomi#
Protoni, neutroni ja elektroni ovat tärkeimmät perushiukkaset.
Protoni (p+) on ytimessä sijaitseva positiivisesti varautunut hiukkanen. Yksinkertaisimmalla alkuaineella, vedyllä (H), on yksi protoni ytimessään.
Neutroni (n) on ytimessä sijaitseva hiukkanen, jolla ei ole varausta. Neutronin massa on melkein yhtä suuri kuin protonin massa.
Elektroni (e-) on negatiivisesti varautunut hiukkanen, joka kiertää ydintä kaukana elektronipilvessä tietyllä energiatasolla. Elektronit, tarkemmin sanottuna ulkoelektronien lukumäärä, määrää alkuaineiden kemialliset ominaisuudeta. Atomissa protoneita ja elektroneita on aina yhtä paljon, jolloin atomi on sähköisesti varaukseton. Lähes kaikki atomin massasta on keskittynyt ytimeen, sillä protonin massa on lähes 2000-kertainen elektronin massaan verrattuna.
Varaus#
tarkoittaa tämän materiaalin yhteydessä niin sanottua alkeisvarausta, jonka suuruus on \( 1.602 \cdot 10^{-19} \ \text{C} \) eli Coulombia. Kun asiaa ajatellaan sähkövirran mielessä, yksi ampeeri kuvastaa sitä, että virtajohtimen läpi kulkee yhden Coulombin verran alkeisvarauksia sekunnissa. Tämä vastaa \( \frac{1}{1.602 \cdot 10^{-19}} \approx 6.24 \cdot 10^{18} \) kappaletta elektroneita.
Järjestysluku (Z)#
kertoo atomin ytimessä olevien protonien määrän. Sähköisesti varauksettomilla atomeilla järjestysluku kertoo myös elektronien lukumäärän.
Massaluku (M)#
kertoo atomin ytimessä olevien protonien ja neutronien lukumäärän yhteensä. Jos atomin järjestysluku ja massaluku tunnetaan, voidaan neutronien lukumäärä laskea vähentämällä massaluvusta järjestysluku: neutronien lkm = M – Z
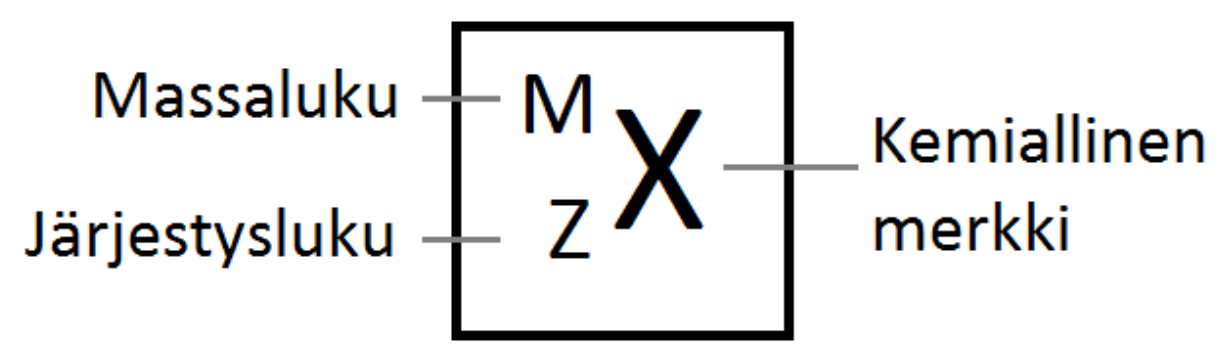
Fig. 2 Järjestysluku Z ja Massaluku M#
Voit tutustua ja rakentaa atomeja seuraavan linkin takaa löytyvän appletin avulla. PhET: rakenna atomi
Isotooppi#
on saman alkuaineen atomi, jolla on eri määrä neutroneja ytimessään. Esimerkiksi vedyn isotoopit ovat tavallinen vety, deuterium ja radioaktiivinen tritium. Osa alkuaineen isotoopeista on stabiileja ja osa hajoaa radioaktiivisesti lähes samantien tai pitkän ajan kuluessa kuva tai linkki. Isotooppeja hyödynnetään monella eri alalla, kuten terveydenhuollon kuvantamismenetelmissä, orgaanisen materiaalin iänmäärityksessä \( (_6^{14}C) \), geologian tutkimuksissa, teollisuudessa laadunvalvonnassa ja tuotantoprosessien seuraamisessa sekä tietysti ydinfysiikassa ja ydinvoimaloissa.
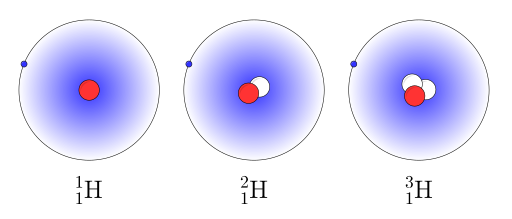
Fig. 3 Vedyn isotoopit: tavallinen vety, deuterium ja radioaktiivinen tritium#
Voit tarkastella kymmenen pienimmän atomin isotooppeja ja niiden suhteellista osuutta luonnossa seuraavan linkin avulla: PhET: isotoopit ja atomimassat
Atomimassayksikkö (1 u)#
on tapa ilmaista perushiukkasten ja atomien massoja yksinkertaisesti. Atomimassan perusyksikkö on 1/12-osaa hiili-12 isotoopin massasta, mikä vastaa suunnilleen yhden protonin massaa. Tällöin \( 1 \ \text{u} = 1.661 \cdot 10^{-27} \ \text{kg} = m(p^+) \). Taulukkoarvot atomien massoista on ilmaistu suhteellisina atomipainoina. Esimerkiksi hiilen taulukkoarvo on 12.011, mikä johtuu siitä, että suurimmalla osalla luonnossa esiintyvistä hiiliatomeista on 6 neutronia ytimessään, mutta pienellä määrällä on 7 neutronia tai jopa 8 neutronia. Taulukkoarvot ovat siis keskimääräisiä atomimassoja painotettuna suhteellisella esiintyvyydellä luonnossa, koska emme voi tarkasti tietää, mitä isotooppia näytteessä on.
Kun puhutaan molekyyliyhdisteen sisältämien atomien massojen summasta, käytetään termiä molekyylipaino.
Ioni#
syntyy atomista, joka on luovuttanut tai vastaanottanut elektroneita. Ionilla on täten varaus, joko positiivinen tai negatiivinen. Metalliatomeilla on kyky luovuttaa elektroneja, joten ne voivat esiintyvät positiivisina ioneina. Epämetalleilla on kyky vastaanottaa elektroneja, joten ne voivat esiintyvät yhdisteissä negatiivisina ioneina.
Perusvuorovaikutukset#
Sähkömagneettisen vuorovaikutuksen mukaan samanmerkkiset sähkövaraukset hylkivät toisiaan ja vastakkaismerkkiset varaukset vetävät toisiaan puoleensa.
Vahva vuorovaikutus on voimakkain perusvuorovaikutuksista. Sen vaikutus ulottuu vain lyhyelle etäisyydelle ytimen sisällä ja se pitää atomin ytimen koossa, vaikka positiiviset protonit hylkivät toisiaan. Sen vuoksi kaukana ytimestä olevat elektronit eivät ole vahvan vuorovaikutuksen alaisuudessa ja niiden voima- ja varausominaisuudet määrittyvät sähkömagneettisen vuorovaikutuksen kautta.
Muut perusvuorovaikutukset ovat heikko vuorovaikutus, joka liittyyy atomin ytimen ilmiöihin, sekä gravitaatiovuorovaikutus, jonka vaikutus atomitasolla on häviävän pieni.
Aineiden luokittelu#
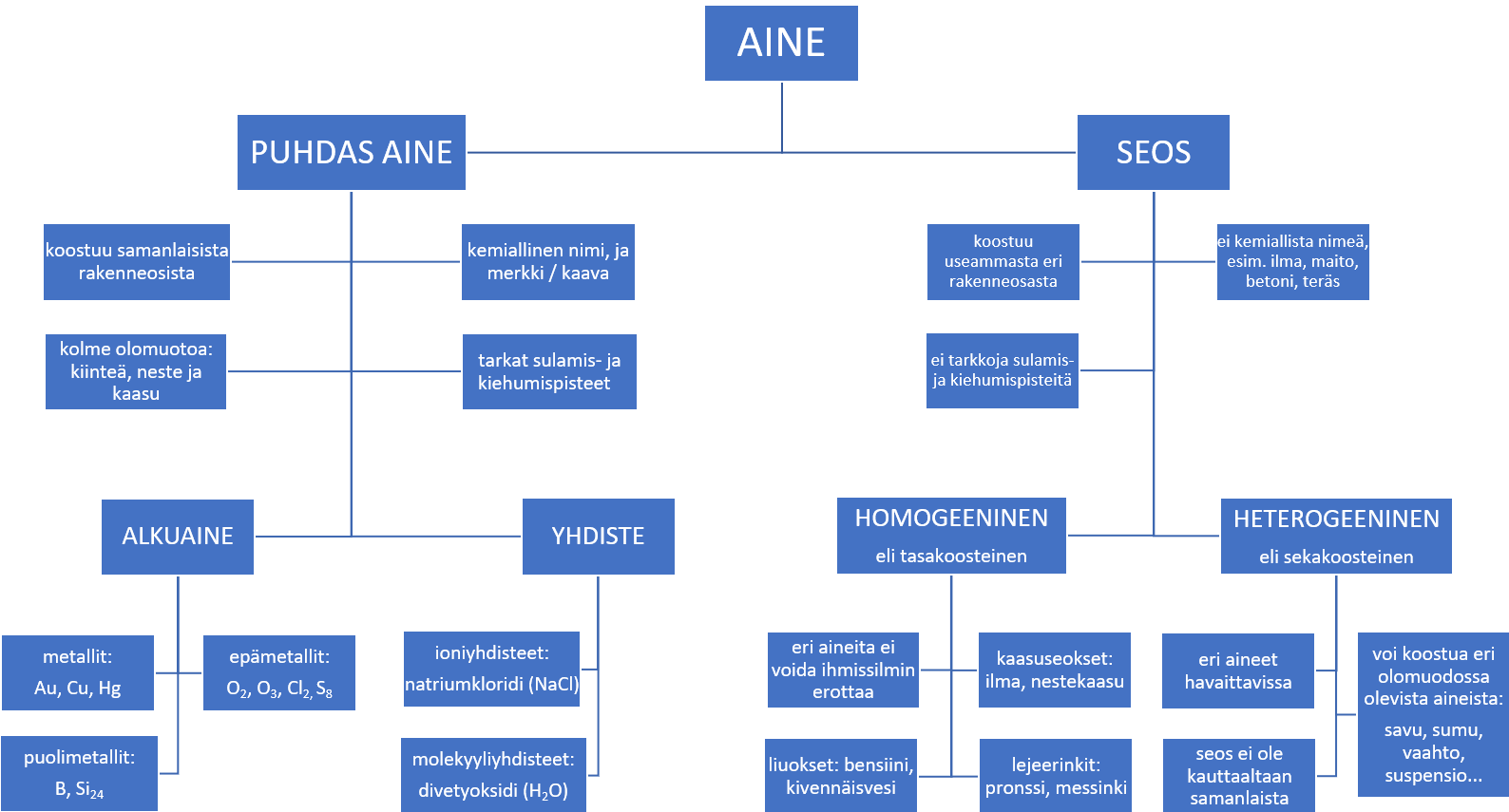
Fig. 4 Aine voi olla puhdasta ainetta tai seosta.#
Puhdas aine#
koostuu vain yhdestä komponentista, alkuaineesta tai yhdisteestä. Puhdasta ainetta voidaan pitää kemiallisesti homogeenisena, eli sen ominaisuudet ovat kaikkialla samat. Esimerkkejä puhtaista aineista ovat luonnossa usein puhtaana esiintyvä kulta \( (Au) \), puhdas vesi \( (H_2O) \), helium \( (He) \) ja muut jalokaasut sekä kloorikaasu \( (Cl_2) \).
Alkuaine#
Kts. sivun alku.
Fig. 5 Alkuaineet ovat puhtaita aineita. Kuvassa kaksiatominen happimolekyyli, O2.#
Yhdiste#
(kemiallinen yhdiste) on aine, joka koostuu kahdesta tai useammasta eri alkuaineesta. Yhdisteillä on oma, tietty kemiallinen kaava, joka kuvaa alkuaineiden määrällistä suhdetta toisiinsa. Esimerkkejä yhdisteistä ovat vesi \( (H_2O) \), ruokasuola \( (NaCl) \) ja hiilidioksidi \( (CO_2) \). Yhdiste voi olla
metalliyhdiste
ioniyhdiste
molekyyliyhdiste
kompleksiyhdiste
Fig. 6 Kemialliset yhdisteet ovat puhtaita aineita. Kuvassa molekyyliyhdiste ammoniakki, NH3.#
Seos#
koostuu kahdesta tai useammasta eri alkuaineesta tai yhdisteestä. Seokset eivät ole yhdisteitä, sillä niissä ainesosat eivät ole kemiallisesti sitoutuneet toisiinsa.
Fig. 7 Seos koostuu kahdesta tai useammasta eri aineesta, jotka eivät ole kemiallisesti sitoutuneet toisiinsa.#
Homogeenisessa eli tasakoosteisessa seoksessa aineita ei voida erottaa silmin, toisin kuin heterogeenisessa seoksessa, jossa aineet ovat eri faaseissa. Esimerkkejä homogeenisista seoksista ovat mm. rasvaton maito, etikka, nestekaasu ja ilma. Heterogeenisiä seoksia ovat mm.
sumu
nestepisaroita kaasussa
Nesteen tulee muodostaa sen verran pieniä pisaroita, että ne pysyvät lämpöliikkeen vaikutuksesta kaasufaasin seassa. Täten yksittäiset vesimolekyylit tai sadepisarat eivät muodosta sumua. Muita esimerkkejä ovat mm. suihkutettavat deodorantit ja spray-maalit.
savu
kiinteitä hiukkasia kaasussa
Painovoiman ja ajan vaikutuksesta pöly ja savun partikkelit voivat lasketua alas astian pohjalle tai maahan.
vaahto
kaasukuplia, kuten ilmaa, nesteen sisällä
Vaahto on harvoin tasalaatuista, joten sen koostumus voi vaihdella eri kohdissa.
emulsio
kahden toisiinsa liukenemattoman nesteen seos
Toinen nesteistä on jakautunut toiseen nesteen pieninä pisaroina. Ajan kuluessa kerrokset voivat jakautua erilleen tiheyserojen mukaisesti. Esimerkkejä emulsioista ovat rasvainen maito sekä ja öljyn ja veden seos.
liete eli suspensio
kiinteitä hiukkasia nesteessä
Liukenemattomat hiukkaset voivat laskeutua astian pohjalle, jos seos jätetään seisomaan. Esimerkkejä suspensioista ovat hiekka-vesi-seos ja maalit.
geeli
nestettä kiinteässä aineessa
Geelin rakenne muodostuu kiinteiden hiukkasten ja nesteen välisestä kolmiulotteisesta verkosta. Kiinteä aine pystyy imemään itseensä nestettä ja turpoaa. Esimerkkejä geelistä ovat hyytelö ja hammastahna.
Lisäksi on mahdollista, että kiinteään aineeseen on sekoittuneena kaasua, kuten esimerkiksi epäpuhtaissa metalleissa (vetyä palladiumin seassa). Kolloidi on yleisnimitys heterogeenisille seoksille, joissa kaikissa olomuodoissa olevia pieniä hiukkasia on jakautuneena nesteeseen tai kiinteään aineeseen.
Myös teräsbetonin voidaan ajatella olevan kemian mielessä seos. Kun betoniin yhdistetään terästankojen tai -verkkojen hyvä vetolujuus, betonirakenteesta tulee kestävämpi ja vahvempi. Teräs ja betoni ovat lämpölaajenemisominaisuuksiltaan hyvin lähellä toisiaan, jolloin lämpötilanmuutokset eivät aiheuta teräsbetonirakenteisiin suurta sisäistä painetta.

